A. PRÄZYGOTISCHE ISOLATIONSMECHANISMEN
1. ISOLATION DURCH BESIEDLUNG VERSCHIEDENER BIOTOPE
Das Beispiel der beiden weitverbreiteten 'Sperlingsarten' Passer domesticus und P. hispaniolensis (Haus- und Weidensperling) dürfte zu den instruktivsten Beispielen der Problematik einer Artabgrenzung durch unterschiedliche Biotope gehören, weshalb es schon oft in der Literatur zum Artbegriff diskutiert wurde (Meise 1936; Stresemann 1936; Goldschmidt 1940; Mayr 1963/1967; Senglaub 1982 und viele andere).
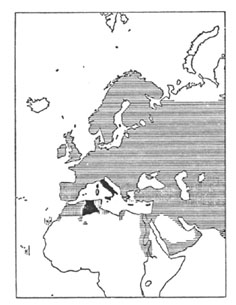
Wie die Verbreitung der beiden Arten zeigt, sind sie in weiten Gebieten sympatrisch, d.h. sie leben in den meisten Gegenden beieinander ohne sich zu paaren und Nachkommen aufzuziehen. "Diese scharfe Trennung herrscht in Spanien, Marokko, auf dem Balkan, in Kleinasien, im Iran und in Turkistan" (Mayr). Stresemann erwähnte noch zusätzlich die scharfe Trennung für Palästina. Im allgemeinen wird in der Literatur hervorgehoben, dass in diesen Gebieten der Trennung der Haussperling stark an menschliche Siedlungen gebunden ist, während der Weidensperling (wie der Name schon sagt) in Weiden und anderen Gehölzarten häufig in der Nähe von Flüssen sowie anderen Gewässern vorkommt.
Abb. 4: Weite sympatrische Verbreitung des Haussperlings, Passer domesticus (waagerecht gestreift) und des Feldsperlings, Passer hispaniolensis (senkrecht gestreift). Kreuzung und Introgression (schwarz) in verschiedenen mittelmeerischen und afrikanischen Gebieten. Nach Meise aus Mayr 1967.
Die auf der folgenden Seite wiedergegebenen Abbildungen und Beschreibungen der beiden Arten sind dem Werk von Garms FAUNA EUROPAS 1977/1982, pp. 218/219 entnommen. Die Verbreitungsangaben sind gemäß der Zielsetzung des Werkes auf Europa beschränkt. Es fällt auf, dass für den Weidensperling u.a. auch menschliche Siedlungen als Teil seines Lebensraums angegeben werden (was uns Mayr im nächsten Zitat erklärt). Für unsere Frage nach dem Artbegriff ist nun von größtem Interesse, dass trotz der scharfen Trennung der beiden Sperlingsformen in weiten Bereichen ihres gemeinsamen Auftretens, dennoch in mehreren Arealen eine starke Bastardierung zwischen ihnen auftritt. Das ist z.B. in Tunis, Italien einschließlich Sizilien, in Korsika und Kreta der Fall. "Die Umstände sind von Ort zu Ort verschieden. Manchmal herrscht die eine Art vor, während die andere selten ist und gelegentlich Bastarde auftreten. Häufiger umfasst die Bastardpopulation phänotypisch die beiden Elternarten und alle denkbaren Kombinationen der elterlichen Merkmale, ein Hinweis auf vollständig zufällige Paarung. Endlich kennen wir einige Gebiete, wie Italien und die Oasen des südlichen Tunesiens, wo sich ein intermediärer Bastardtypus stabilisiert hat und die elterlichen Extreme verschwunden sind. Einen Hinweis auf den Ursprung der Bastardierung liefert die Tatsache, dass der Weidensperling in verschiedenen Gebieten, wie auf Sardinien, im östlichen Tunesien und in der Cyrenaika, die ökologische Nische des Haussperlings (menschliche Niederlassungen!) besetzt. Wo der aggressive Passer domisticus in solche Gebiete eindringt, sind - beim Fehlen einer ökologischen Trennung - die Bedingungen für eine Aufhebung der Fortpflanzungsisolation gegeben (Mayr 1967, pp. 101, 102).
Abb. 5: Haussperling. Aus Garms 1977/1982
Größe bekannt; Scheitel einfarbig, beim Männchen grau, beim Weibchen braun; Kehle beim Männchen schwarz, beim Weibchen schmutziggrau; 15 cm
Verbreitung: Fast
ganz Europa; fehlt: Island, Norden
Skandinaviens, Finnlands, der UdSSR; Italien,
Korsika: Italiensperling.
Lebensraum und Lebensweise: menschliche Siedlungen; lebt gesellig
in
Kolonien; am Boden breitbeinig hüpfend; kälteempfindlich, zieht
sich im Winter gern in warm gepolsterte Schlafnester
zurück; Jahresvogel
Nahrung: Getreide, Knospen, Insekten, Abfälle.
Fortpflanzung: halbkugeliges, kunstloses Nest unter Dachpfannen,
Mauervorsprüngen, in Nistkästen: 3 (3-4) Bruten
März-August; Eier 5-6 (4-8), weiß, hellgrün, -blau, -grau
oder -braun und verschiedenfarbig dunkel gefleckt; Brutdauer
(11-) 13-14
Tage; Männchen und Weibchen brüten, betreuen die Jungen,
die mit
(13-16) 17 Tagen das Nest verlassen. Höchstalter 7, im Durchschnitt
2-3 Jahre. Nesthocker.
Ruf: "tschilp-tschilp", "tetetet", "err".
Gesang: "dieb-dürr"
Abb. 6: Weidensperling. Aus Garms 1977/1982.
So groß wie Haussperling; Männchen ähnlich dem Italiensperling, aber Schwarz an Kehle und Brust viel ausgedehnter; Weibchen ähnlich dem Männchen des Haussperlings; 15 cm
Verbreitung: Mittel-, Südspanien,
Griechenland, Sardinien.
Lebensraum: Wälder, Gebüsche, menschliche
Siedlungen; Jahresvogel
Nahrung: Getreide, Knospen, Insekten, Abfälle.
Fortpflanzung: Nest in Bämen, unbesetzten Nestern
anderer Vögel (z.B. im Unterbau der Nester von Störchen, Adlern,
Krähen usw., auch wenn diese besetzt
sind); Kolonienbrüter und Nesthocker.
Ruf und Gesang: ähnlich Haussperling.
Der Weidensperling ist also keineswegs irreversibel an das erstgenannte Biotop von Weiden und anderen Gehölzen in der Nähe von Gewässern gebunden.
Abb. 7: Italiensperling. Aus Garms 1977/1982.
So groß wie Haussperling, diesem sehr ähnlich, aber Scheitel im Brutkleid (Männchen) kastanienbraun; Weibchen ähnlich dem Weibchen des Haussperlings; 15 cm
Verbreitung: Italien, Korsika.
Lebensraum, Nahrung, Fortpflanzung, Ruf und Gesang: wie
Haussperling.
Vergleicht man die Abbildungen der drei 'Arten' miteinander, so wird klar, dass sich praktisch nur die Männchen voneinander unterscheiden, und zwar in Merkmalen, die - gemessen an der Variabilität von Farben und Farbverteilungen innerhalb zahlreicher Vogelarten - doch recht geringfügig sind (hier die Größe des 'Lätzchens' an Kehle und Brust von Haus- und Weidensperling und dem im Brutkleid kastanienbraunen Scheitel beim Italiensperling).
Wie schon erwähnt, bestehen keinerlei genetische Schranken zwischen den drei Formen.
Bei genauerer Betrachtung der Verbreitungsangaben nach Garms erhält man den Eindruck, dass die Verbreitungskarten nicht immer genau mit den Verbreitungsangaben übereinstimmen. Obwohl für Passer domesticus angegeben wird, dass er an mehreren Stellen Europas fehlt (Island, Norden Skandinaviens, Finnlands und UdSSR) und dass in Italien und auf Korsika der Italiensperling heimisch ist, wird das letztere auf der Verbreitungskarte nicht berücksichtigt. Statt dessen findet man den Haussperling auch in ganz Südeuropa und Nordafrika (vgl. Abb. 5), was, wie wir schon gehört haben, zum Teil ja auch zutrifft (sowohl in Gebieten mit scharfer Trennung als auch in Gebieten mit Bastardpopulationen, unter denen auch beide Elterntypen auftreten).
Der Italiensperling wird für Italien und Korsika vermerkt, nach der Karte kommt er auch auf Sardinien vor (Abb. 7).
Senglaub schreibt in seiner einführenden Arbeit 1982, p. 152, dass auf Korsika und ganz Italien die beiden Arten Passer domesticus und Passer hispaniolensis fehlen und fährt fort:
Dafür leben dort Sperlingspopulationen, die als Italiensperlinge (Passer itáliae) beschrieben wurden und im Aussehen eine Mittelstellung zwischen Weidensperling und Haussperling einnehmen. Sehr wahrscheinlich sind die Italiensperlinge das Ergebnis des lokalen - auf Italien und Korsika beschränkten - Zusammenbruchs isolierender Barrieren. In Gefangenschaft erzielte Bastarde von Weidensperling und Haussperling sehen in der Tat ganz so aus wie Italiensperlinge.
(Seng Laub vermerkt jedoch nicht die Kreuzung und Introgression in den nordafrikanischen Gebieten.)
Zu Garms: Es ist klar, dass intermediäre Bastardpopulationen sowie Bastardpopulationen mit allen möglichen Rekombinanten als Übergangsformen von einer 'Art' bis zur anderen (einschließlich der Eltern) manchmal schwer als verschiedene Arten mit genauen Verbreitungsangaben zu klassifizieren sind, so dass sich aus dieser Situation schon einige Schwierigkeiten für die Aufführung und Darstellung solcher Daten ergeben, d.h. die Schwierigkeiten liegen zum Teil in der Unschärfe der Daten selbst. (Weitere Daten dürften bei J. D. Summers-Smith in seiner Monographie (1988: The Sparrows. A Study of the Genus Passer. Buteo Books. Vermillion, South Dakota; 342 pp.) zu finden sein. Ich habe jedoch das Buch noch nicht einsehen können.)
Die entscheidende Frage ist: Handelt es sich bei diesem Beispiel nun um eine einzige Art oder um zwei Arten - oder bei Berücksichtigung weiterer Rekombinanten und ihrer Verbreitung - um drei oder noch mehr Arten? Goldschmidt hat schon vor vielen Jahren folgenden Vorschlag gemacht (1940, p. 155):
As a taxonomist, do with them what happens to be practical. But as an evolutionist, treat them as members of one species, which they most clearly are, though they do not interbreed in some localities, just as the Brahmin does not interbreed with a Pariah, his own near biological relative. But the subspecies Brahmin or Indian could breed successfully with as different a subspecies as an Eskimo, if he wanted to.
Das ist der Ratschlag an den Evolutionstheoretiker, der sich die Frage stellt, ob über unterschiedliche Biotopbevorzugung neue Arten entstehen.
Aus genetischer Sicht ist der Rat überzeugend: Wo immer sich diese Sperlingsformen miteinander paaren, haben sie fertile Nachkommen und ganze Bastardpopulationen mit allen möglichen Rekombinanten sind in der Natur vorhanden. Der Rat an den Taxonomen erscheint dabei weniger befriedigend. Die Schwierigkeiten einer Bastardpopulation für die Taxonomie haben wir oben schon angedeutet und es wäre gut, wenn man die biologische Realität mit der Taxonomie auf einen gemeinsamen Nenner bringen könnte. Wir wollen später auf diese Frage zurückkommen und uns zunächst ein Beispiel aus der Botanik näher ansehen, um dann zu einer Auflistung bekannter Beispiele überzugehen.
Stebbins berichtet über die Schwarz- und Scharlacheiche 1980, p. 125 folgendes:
Standortisolation ist bei Pflanzen wegen ihrer Ortsgebundenheit sehr häufig; sie wirkt in zweierlei Weise. Die Arten können zwar im gleichen weiteren Bereich leben, aber so verschiedenartige Standortansprüche haben, daß ihre Populationen selten nahe genug vorkommen, um zahlreiche Kreuzungen zu ermöglichen. Hinzu kommt, daß gelegentliche Hybriden unter natürlichen Bedingungen außerstande sind, zur Reife zu gelangen oder zahlreiche Nachkommen zu hinterlassen, weil kein Standort verfügbar ist, an den sie angepaßt sind. Hierfür gibt es viele Beispiele unter den Baum- und Straucharten im Osten der Vereinigten Staaten, wie etwa die Scharlacheiche (Quercus coccinea) und die Schwarzeiche (Quercus velutina) (Abb. 8). Diese beiden Arten kommen im größten Teil des Ostens sympatrisch vor und sind leicht durch die Form ihrer Blätter und Eicheln auseinanderzuhalten. Zwischenformen sind viel weniger häufig als die typischen Bäume der Scharlach- bzw. Schwarzeiche, so daß die beiden Arten in den Populationen ihre Identität fast über das gesamte riesige Verbreitungsgebiet behalten. Dies beruht hauptsächlich darauf, daß die Scharlacheiche Sümpfe oder schlecht drainiertes Schwemmland mit sauren Böden besiedelt, während die Schwarzeiche auf trockeneren, gut durchlüfteten Böden des Hochlandes vorkommt. An einigen Stellen, wie am Nordufer von Long Island, New York, sind gemischte Standorte relativ häufig, und die Trennung der Arten bricht zusammen.
Abb. 8: Zwei Eichenarten, (A) Schwarzeiche (Quercus velutina) und (B) Scharlacheiche (Q. coccinea), die in einigen Teilen ihres sympatrischen Vorkommens ganz gesondert voneinander bleiben und in anderen große intermediäre Hybridpopulationen bilden. (Aus Stebbins 1980 nach Preston.)
Wir können an dieser Stelle wieder die gleiche Frage wie oben stellen: Handelt es sich bei diesen Eichen nun um eine einzige Art, um zwei oder - unter Einbeziehung der Rekombinanten - um zahlreiche Arten? Wenn man nicht die Schlussfolgerung ziehen möchte, dass es sich bei diesen Formen in Abhängigkeit von den Arealen einmal um zwei und dann wiederum um eine einzige Art handelt, wobei Letztere die beiden Ersteren und weitere Rekombinanten miteinschließt (- denn was macht man mit den die Eltern repräsentierenden Rekombinanten einer Mischpopulation? Hier würde es sich gleichzeitig sowohl um zwei, nämlich die 'Elternarten', als auch um eine einzige Art, die Mischpopulation, handeln -), dann gibt es nur die eine vernünftige Alternative: In allen diesen Fällen handelt es sich um Ökotypen einer einzigen Art.
Zahlreiche Beispiele dieser Art sind aus der Zoologie und Botanik bekannt geworden. Zunächst einige Beispiele für in der Natur vorkommende Introgression und/oder Bastardschwärme von Tieren (zusammengestellt nach Mayr 1967, Dobzhansky 1977, Rieppel 1983 u.a.)
WEITERE BEISPIELE AUS DEM TIERREICH
|
Vögel |
Terpsione viridis |
x |
T. rufiventer |
|
|
T. viridis |
x |
T. rufocinerea |
|
|
Pipilo erythrophthalmus |
x |
P. ocai |
|
|
Melidetes rufocrissalis |
x |
M. belfordi |
|
|
Criniger calurus |
x |
C. udussumensis |
|
|
Ceyx erithacus |
x |
C. rufidorsus |
|
|
Vermivora chrysoptera |
x |
V. pinus |
|
|
Dendroica dominica |
x |
Parus americana |
|
|
Tympanuchus cupido |
x |
T. phasianellus |
|
|
Passerina cyanea |
x |
P. amoeba |
|
|
Junco hiemalis |
x |
J. oreganus |
|
|
Astrapia mayeri |
x |
A. stephaniae |
|
|
Megapodius freycinet offinis |
x |
M. f. eremita |
|
|
Corvus corone corone |
x |
C. c. cornix |
|
Igel |
Erinaceus europaeus |
x |
E. roumanicus |
|
Hirschmaus |
Peromyscus leucopus |
x |
P. gossyinus |
|
Spitzmaus |
Sorex vagrans |
x |
S. oranatis |
|
Schlange |
Pituophis catenifer |
x |
P. sayi |
|
Kröten |
Bufo fowleri |
x |
B. americanus |
|
|
B. fowleri |
x |
B. woodhousei |
|
Engmaulfrosch |
Microhyla carolinensis |
x |
M. olovaceae |
|
Salamander |
Batrachseps attenuatus |
x |
B. pacificus |
|
|
Triturus cristatus cristatus |
x |
T. marmoratus |
|
Stichling |
Gasterosteus aculeatus |
x |
G. trachurus |
|
Schmetterling |
Pieris napi |
x |
P. bryoniae |
|
Hüpferlinge |
Daphnia middendorfina |
x |
D. schoedleri |
|
|
D. middendorfina |
x |
D. pulex |
Außerdem ließen sich verschiedene Rädertiergattungen sowie weitere Vogelgattungen zitieren, wie z.B. Sitta, Aegithalos, Lanius, Motacilla, Quiscalus, Colaptes, Bonasa, Zonotrichia, Persoreus, Lophura, Paradisaea, Pachycephalus und von den Schmetterlingen die Gattungen Chlorochroa, Colias und Papilio u.v.a.
Wie erwähnt, handelt es sich bei dieser Aufführung nur um einige bekanntere Beispiele - die Liste ist also alles andere als vollständig.
Kommen wir nun zu einigen Beispielen für Hybridpopulationen zwischen verschiedenen 'Arten' bei Pflanzen (zusammengestellt nach Angaben von Grant 1976 und Rauh/Senghas 1982/1988):
WEITERE BEISPIELE AUS DEM PFLANZENREICH
|
Antirrhinum majus |
x |
A. glutinosum |
|
Aquilegia formosa |
x |
A. Pubescens |
|
Drosera rotundifolia |
x |
D. anglica (= D. x obováta) |
|
D. rotundifolia |
x |
D. intermedia (= D. x beleziána) |
|
D. anglica |
x |
D. intermedia |
|
Geum rivale |
x |
G. urbanum |
|
Helianthus annuus |
x |
H. bolanderi |
|
Juniperus virginiana |
x |
J. scopulorum |
|
Picea marina |
x |
P. glauca |
|
Pinus coulteri |
x |
P. jeffreyi |
|
Salix incana |
x |
S. daphnoides |
|
Sorbus aria |
x |
S. aucuparia (= S. x bougotii) |
|
Sorbus graeca |
x |
S. aucuparia (= S. x austria) |
|
Iris fulva |
x |
I. giganticaerulea |
|
Trifolium repens |
x |
T. pratense |
|
Phlox bifida |
x |
P. amoea |
Über die Häufigkeit von Hybridpopulationen im Pflanzenreich berichtet Grant 1976, p. 117 sowie 1981, p. 196:
Um 1891 konnte Kerner ein Verzeichnis von in der Natur vorkommenden Bastarden aus der europäischen Flora aufstellen, das über 1000 Kombinationen verschiedener Arten umfaßte und zahlreiche Gruppen von Moosen, Farnen und Schachtelhalmen bis zu Koniferen, Laubbäumen und krautigen Angiospermen enthält (Kerner, 1894-1895, Bd.2 S.582 - 586). Neuere Verzeichnisse von natürlichen Bastarden wurden von Allan (1949) und Heiser (1949 a) gebracht.
Über den heutigen Stand der Forschung bemerkt er auf der Seite 118 (bzw. 197):
Ein vollständiges Verzeichnis natürlicher Hybride und Hybridschwärme würde von Achillea bis zu Zinnia reichen. Gelegentliche oder sporadisch auftretende natürliche Bastardierung ist im Pflanzenreich normal, wenn zwei oder mehr verwandte Arten in Kontakt kommen.
Obwohl es für den letzteren Punkt auch zahlreiche Ausnahmen gibt, so steht doch fest, dass natürliche Hybride und Hybridschwärme zwischen verwandten Arten im Pflanzenreich so häufig vorkommen, dass dies eher die Regel als die Ausnahme ist. (Hunderte von Beispielen auch bei Hegi bis 1987 und Fortsetzung.)
Wir haben oben schon darauf aufmerksam gemacht, zu welchen logischen und praktischen Schwierigkeiten es führt, unterschiedlichen Formen, die miteinander voll fertil sind und darüber hinaus noch in der Natur durch eine Kette vermittelnder Rekombinanten verbunden werden, Artstatus zuzuschreiben: Solange man sie gut unterscheiden kann, sind es auch "gute" Arten, setzt sich eine weitere von den in der Regel vielen möglichen Rekombinanten in einem bestimmten geographischen Teil der Verbreitung einer Art durch, dann lässt sich auch eine dritte Art gut von den beiden Elternarten unterscheiden - wie oben für die Sperlinge demonstriert. Und mit dieser Methode lassen sich dann u.U. noch viele weitere Arten aufstellen. Finden wir jedoch eine Hybridpopulation mit allen rekombinatorischen Übergangsformen, dann sind auch die schönen Abgrenzungen verschwunden und wir haben es in einem solchen Areal mit einer einzigen Art zu tun, die all die 'anderen Arten' genetisch-morphologisch miteinschließt.
Die einzig vernünftige und konsequente Methode, das Problem zu lösen, ist, den Artbegriff weiter zu fassen als das in vielen Fällen bis heute geschieht. Populationen aus Rekombinanten mit unterschiedlichen Biotopansprüchen sollten nicht als systematische Arten betrachtet werden.
Lamprecht hat vor einigen Jahren diesen Punkt für die Rosaceengattung Geum dezidiert wie folgt ausgeführt (1966, pp. 181/182 und 413/414):
Von der Rosaceengattung Geum sind in Mittel- und Nordeuropa die beiden Arten rivale L. und urbanum L. weit verbreitet. G. rivale kommt nur auf feuchtem Gelände, G. urbanum nur auf ziemlich trockenem vor. Im übrigen haben die beiden Arten praktisch genommen dieselbe Verbreitung. Wenn sich diese beiden Arten irgendwo begegnen, entstehen häufig Bastarde, die die gleiche Fertilität wie die Elternarten aufweisen. WINGE (1926 und 1938) führte die Kreuzung rivale x urbanum künstlich aus und studierte eine große Nachkommenschaft. Es gab keine Fertilitätsstörungen und es spalteten in F2 usw. zahlreiche, gleichfalls normal fertile Zwischenformen, d.h. mit verschiedenen Kombinationen der Merkmale der Elternlinien aus.
Im Freien sind von diesen die mit rivale und urbanum übereinstimmenden, ökologisch (hinsichtlich Wasserhaushalt) gut differenzierten Rassen die allein genügend konkurrenzfähigen. Sie bleiben bestehen, die Zwischenformen werden ausgemerzt. Mit der ökologisch verschiedenen Einstellung dieser zwei Rassen geht eine etwas verschiedene Morphologie einher, mit der LINNÉ die Aufstellung der zwei gut bekannten "Arten" begründete. Es bedarf wohl keiner weiteren Erörterung, daß es sich bei diesen beiden "Arten" nur um ökologische Rassen ein und derselben Art handeln kann, die aus dem reichen Varietätenmosaik dieser durch die Wirkung der Unweltverhältnisse ausgelesen worden sind.
Die Rassen einer Art, die im Kampf ums Dasein in der Natur übrigbleiben, ob sie nun verschiedene geographische Ausbreitung haben oder morphologisch oder ökologisch mehr oder weniger stark voneinander abweichen, dürfen keineswegs zum Rang selbständiger Arten erhöht werden, wie dies bisher von Systematikern immer und immer wieder geschehen ist. Mit Hinblick auf die traditionellen Arbeitsmethoden der Systematiker, ohne Berücksichtigung der genetischen Beziehungen solcher Rassen zueinander, sind solche Ergebnisse auch unvermeidlich und voll verständlich. Solche Arten sind demnach als nur von konventioneller Natur zu betrachten. Sie sind der naturbedingten, durch eine genisch-plasmatische Barriere von allen übrigen getrennten Art untergeordnet.
In GAJEWSKIS Arbeit "A cytogenetic study on the genus Geum L." (1957) finden sich Angaben über die Fertilität von sowohl Pollen wie Samen einer Reihe von Kreuzungen mit G. rivale L. Für rivale x urbanum sind diese Werte 78,0 bzw. 72,1 %. Bei Kreuzung von rivale mit coccineum SIBTH. et SM. wurde gefunden: 66,6 bzw. 94,5 % mit silvaticum Pourr. 74,6 bzw. 60,3 %, mit molle VIS. et PANG 62,1 bzw. 61,5 % und mit hispidum FR. 83,1 bzw. 60,4 %. Mit Hinblick auf diese Werte kann man vermuten, daß sich diese vier Arten in Kreuzungen mit rivale ebenso verhalten könnten wie urbanum. Genanalytische Untersuchungen in F2 liegen leider nicht vor.
Zu Geum rivale und Geum urbanum hebt Lamprecht weiter hervor:
Wo sie sich, bei geringerem Abstand voneinander, begegnen, kann der Bastard intermedium angetroffen werden. Und dieser, wie auch seine Nachkommen sind vollkommen fertil (s. WINGE 1. c.). Die Nachkommen spalten in allen die Eltern trennenden Merkmale und Eigenschaften. Aber im Freien verbleiben als konkurrenzkräftig nur die den beiden Eltern entsprechenden Typen, rivale und urbanum. Damit ist eindeutig bewiesen, daß es sich in diesem Fall nur um zwei stark verschiedene Ökotypen ein und derselben Spezies handelt. Und solche Fälle sind keineswegs selten, es gibt ihrer recht viele, so z.B. Lolium perenne und multiflorum, die Pisum-Arten usw. (s.o).
Heß kommentiert dieses Beispiel 1983, pp. 408/409:
Die Bach-Nelkenwurz blüht früher, die Echte Nelkenwurz später im Jahr. Doch können sich die Blütezeiten überlappen. Die unterschiedlichen Standorte verhindern allerdings normalerweise auch dann noch die Hybridisierung. Das kann sich mit dem Eingreifen des Menschen ändern. Die Echte Nelkenwurz folgt ihm getreu ihrem Hang zum Unkrautdasein oder auch dann, wenn er z.B. neue Wälder und damit Waldränder anlegt. Sie kann so in die Bereiche der Bach-Nelkenwurz gelangen. Besonders in England war das bei Aufforstungen der Fall. Dabei kam es zur Hybridisierung zwischen den beiden anscheinend doch so verschiedenen Arten. Die Hybridpflanzen, die man im übrigen auch durch experimentelle Kreuzungen herstellen kann, nehmen eine Mittelstellung zwischen den beiden Stammarten ein. Sie sind voll fertil (von Hybridsterilität keine Spur!) und spalten in ihren Nachkommenschaften wie zu erwarten in den verschiedensten Kombinationen auf.
Nur die normalerweise gegebene ökologische Trennung verhindert bei den beiden [zuvor zitierten] Primel- und den beiden Nelkenwurzarten sowie in weiteren Fällen einen Genfluß über die Artgrenzen hinweg. Man kann fragen, ob man unter solchen Umständen überhaupt noch von Arten sprechen kann. Denn der gängigen Definition, die die reproduktive Isolation als Kriterium benützt, entsprechen sie ja nur dann, wenn sie räumlich voneinander getrennt sind. Wir hatten aber schon darauf hingewiesen, daß besonders Botaniker hier nicht immer konsequent sind - wie ersichtlich, mit gutem Grund. Sie ließen sich das Hintertürchen der "Morphospecies" offen. Dieser Begriff läßt sich auf Arten anwenden, die in ihrer Fortpflanzung nur ökologisch voneinander isoliert sind.
Der gute Grund ist also die gute morphologische Unterscheidbarkeit der beiden Ökotypen! Für den genetisch motivierten Artbegriff reicht das jedoch nicht aus: jeder Genetiker weiß, dass bei der Kreuzung verschiedener Linien, die sich in mehreren Allelen unterscheiden, zahlreiche, morphologisch und ökologisch sehr gut unterscheidbare Rekombinanten entstehen können und dass es sicher nicht vernünftig wäre, solche gut unterscheidbaren Formen mit neuen Artnamen zu belegen. Mit Hilfe des Punnettschen Rekombinationsquadrates kann man sich die Situation für verschiedene Rekombinanten mit unterschiedlichen ökologischen Ansprüchen leicht wie folgt klarmachen: Die beiden Ökotypen sollen die Genkombinationen AA bb CC DD und aa BB cc dd haben. Die F1 hat dann den Genotyp Aa Bb Cc Dd und spaltet bei Kreuzung mit demselben Genotyp in der F2 nach dem 3. Mendelschen Gesetz (vgl. Abb. 10). Der Übersichtlichkeit halber haben wir nur die homozygoten und die maximal heterozygoten Rekombinanten aufgeführt. Unter den maximal 16 verschiedenen klar unterscheidbaren homozygoten Rekombinanten haben unter den gegebenen ökologischen Bedingungen nur wieder die beiden Elternlinien die Chance, sich auf die Dauer durchzusetzen. Ändert sich jedoch die ökologische Situation, so ändern sich unter Umständen auch die Chancen für die verschiedenen Rekombinanten:
In einem Areal, das sich durch eine Kombination sonst weitgehend getrennter Biotopeigenschaften auszeichnet, soll sich die Rekombinante AA BB CC dd am
Abb. 9: (a) Geum rivale. (b) G. urbanum. Aus Briggs und Walters 1984, nach Roles.
Abb. 10: Rekombinationsquadrat.
(Rein formal betrachtet geben die Abbildungen in der vorliegenden Arbeit "Rekombinationsrechtecke" wieder, aber inhaltlich trifft der Begriff "Rekombinationsquadrat" zu, und überdies handelt es sich dabei um einen feststehenden genetischen Begriff.)
Der Übersichtlichkeit halber sind nur die Diagonalen für die unterschiedlichen homozygoten Rekombinanten und die maximal heterozygoten eingetragen.
besten behaupten können, unter anderen ökologischen Bedingungen soll sich die Mehrzahl der verschiedenen Geno- und Phänotypen durchsetzen. Alle Rekombinanten gehören zu ein und derselben Art. Das ist die konsequente und klare Schlussfolgerung nach dem 3. Mendelschen Gesetz unter genökologischen Gesichtspunkten.
Für unsere anfangs gestellte Frage nach den Artenzahlen bedeutet diese Schlussfolgerung eine starke Reduzierung um Zehntausende von "Pseudoarten" (Lamprecht).
Dass sich die Vertreter der Synthetischen Evolutionstheorie dieser Schlussfolgerung im allgemeinen nicht angeschlossen haben, liegt an dem großen Interesse der Theorie, im Werden begriffene Spezies (Spezies in statu nascendi) nachzuweisen. Denn nach dieser Theorie sollen aus Rassen Arten, aus Arten Gattungen, aus Gattungen Familien usw. werden. Diese Frage soll uns im Folgenden noch wiederholt beschäftigen.
An dieser Stelle sei noch erwähnt, dass die meisten Systematiker - von solchen genetischen Erwägungen bislang wenig beeindruckt - fortfahren, die Arten nach den herkömmlichen Methoden zu bestimmen. Man vergleiche zu dieser Aussage moderne Pflanzen- und Tierbestimmungsbücher wie etwa Garcke 1972, Schmeil/ Fitschen 1982; Garms 1977, 1982; Brohmer 1982; Riedl 1983 u.v.a. Wir wollen dabei jedoch nicht die ungeheure Arbeit verkennen, die der Systematiker in seinem Areal vornimmt (vgl. etwa Kolbe 1984; Maiworm 1984). Der Aufschluss über die Vielzahl der genetischen Rekombinanten ist für das Studium der Variabilität der Formen sehr wertvoll (ebenso für ökologische Fragen und Untersuchungen) - nur handelt es sich in zahlreichen Fällen nicht um genetisch definierte Arten, sondern um Morphospezies und Ökotypen, Hybriden und auch selektionsneutrale Rekombinanten (vgl. Kimura 1983).